Computadores descobrem novo tipo de ligação química
Redação do Site Inovação Tecnológica - 27/09/2011
[Imagem: NCSA]
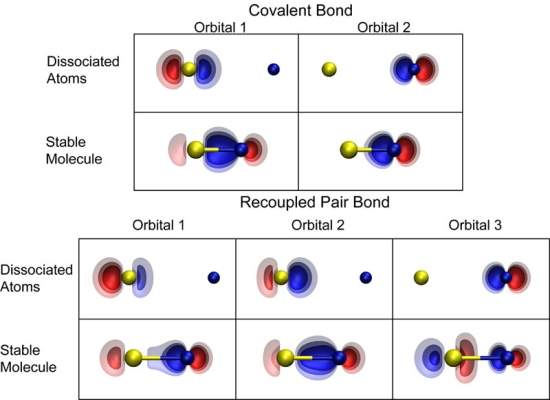
Pares reacoplados
Uma simulação inteiramente feita em computador ajudou químicos a identificarem um tipo de ligação química desconhecida até agora.
"Esse fenômeno tem implicações para toda a química," afirmou Thom Dunning, da Universidade de Illinois, nos Estados Unidos.
Dunning e seus colegas batizaram o novo tipo de ligações química de "ligação de pares reacoplados" (recoupled pair bonding).
"Os químicos sabem há muito tempo que a química dos elementos do grupo principal, do nitrogênio até o flúor, é diferente da química dos elementos nas linhas abaixo na tabela periódica," explica Dunning.
"A questão é: o que torna o fósforo diferente do nitrogênio, ou o enxofre diferente do oxigênio? Parece que este novo tipo de ligação é uma das principais causas dessas anomalias," afirma ele.
Hipervalência
Uma das principais dentre essas anomalias é a chamada hipervalência, uma grande classe de moléculas que forma um número de ligações maior do que o esperado.
A Regra dos Octetos estabelece que os átomos querem ter oito elétrons em sua camada de valência.
Quando se sabe quantos elétrons um átomo tem em sua camada de valência é possível saber como ele irá ganhar, perder ou compartilhar elétrons para formar octetos - o que revela o número de ligações que o átomo pode formar.
Mas as moléculas hipervalentes formam mais ligações do que seria de se esperar, como se tivessem mais do que oito elétrons em suas camadas de valência.
O que os cientistas descobriram agora é que essas moléculas podem formar um outro tipo de ligação química.
Novo tipo de ligação química
Imagine dois átomos, um com 2 e outro com 1 elétron na camada externa. Normalmente, elétrons pareados não participam de uma ligação - é necessário separá-los para que o átomo forme uma ligação.
Alguns átomos, como o flúor, conseguem forçar essa separação. Um elétron do par original é "reacoplado" pelo flúor, formando uma ligação de par reacoplado com o elétron no orbital ocupado por um único elétron.
O outro elétron, que estava anteriormente pareado, está agora disponível para formar uma outra ligação.
Desta forma, tem-se duas ligações onde se acreditava poder haver apenas uma.
"O mais interessante sobre nossa teoria é que ela é uma teoria preditiva," diz David Woon, coautor do estudo. "Quando nós estudamos compostos de fósforo e cloro, nós intuímos como eles se comportariam baseados no que havíamos aprendido com as ligações de pares reacoplados nos compostos de enxofre."
E a "intuição" a partir da nova teoria funcionou, algo que não é explicado pela Regra dos Octetos.
Os cientistas agora planejam escrever um novo livro-texto de Química, dando uma nova explicação sobre como as ligações químicas "realmente" ocorrem.
Artigo: Bonding and Isomerism in SFn-1Cl (n = 1-6): A Quantum Chemical Study
Autores: Jeff Leiding, David E. Woon, Thom H. Dunning Jr.
Revista: Journal of Physical Chemistry A
Vol.: 115 (3), pp 329-341
DOI: 10.1021/jp107916c


Descoberto novo material para célula solar de alto desempenho
Tornado quântico permite estudar buracos negros em laboratório
Novo projeto leva simuladores quânticos a um novo patamar
Supercomputador neuromórfico conseguirá simular cérebro humano inteiro
Nova lei da física propõe: Vivemos em uma simulação de computador
Zentropia e a arte de projetar melhores experimentos e criar novos materiais
Inovação matemática melhora muito detecção de terremotos
Melhor rota para naves espaciais é traçada com teoria dos nós
Monociclo com duas pernas será ideal para fazer entregas
Bateria de ferro totalmente líquida armazena energias renováveis
Fotografado pela primeira vez bizarro cristal formado apenas por elétrons
Criados bits quânticos que mantém dados à temperatura ambiente
Expansão do Universo pode estar desacelerando
Detectada onda gravitacional que pode ajudar a resolver mistério cósmico
Resolvido antigo mistério sobre a formação dos cristais
Único no mundo, chip que funciona com luz é lançado industrialmente
Todos os direitos reservados.
É proibida a reprodução total ou parcial, por qualquer meio, sem prévia autorização por escrito.




